Chúng ta nghe nói đến mưa axit đã nhiều, vậy còn mưa bazơ thì sao nhỉ?
Theo bạn, liệu có mưa bazơ hay không? Đáp án sẽ khiến bạn bất ngờ.
Trước khi tìm hiểu về mưa bazơ, chúng ta cần biết một chút về mưa cũng như mưa axit. Thông thường, người ta sẽ xét tính axit - bazơ của nước mưa dựa trên thang pH. Thang này có 14 nấc, với quy ước pH thấp thì tính axit mạnh, pH cao thì tính bazơ mạnh. Chính giữa thang là các chất trung tính, ví dụ như nước tinh khiết (H2O).

Nguyên tắc đo pH dựa vào nồng độ 2 loại ion là H+ (có tính axit) và OH- (có tính bazơ).
Và chúng ta đều biết nước mưa không phải là nước tinh khiết, mà là hỗn hợp nước và một số chất có trong không khí. Tính chất của nước mưa ngả về bên nào – axit hay bazơ, phụ thuộc vào phản ứng hóa học giữa nước và các chất này.
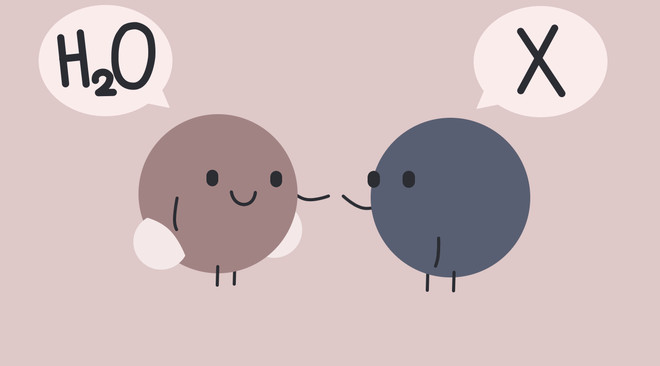
Độ pH trung bình của nước mưa là khoảng 5,6.
Trong không khí luôn có CO2, khiến nước mưa bình thường thực chất cũng có tính axit nhẹ do phản ứng tạo axit cacbonic (H2CO3). Độ pH trung bình của nước mưa là khoảng 5,6 - tuy thấp hơn nước tinh khiết nhưng cũng chưa ở mức có thể gây hại.
Ngoài lượng khí cacbonic luôn thường trực, đôi khi khí quyển của chúng ta cũng chứa cả các khí khác như SO2, SO3, NO, NO2, … có thể hòa tan trong nước tạo ra axit.
Các sản phẩm của phản ứng lần này là các axit mạnh (H2SO4, HNO3,…) với khả năng gây hại cho cây cối, đất đai và con người. Và chúng chính là mưa axit mà các chuyên gia thường hay nói đến.

Đôi khi khí quyển của chúng ta cũng chứa cả các khí khác như SO2, SO3, NO, NO2...
Vậy còn mưa bazơ thì sao?
Tuy nhiên ở những trường hợp hiếm gặp, một vài nơi trên thế giới có bầu không khí chứa CaCO3, NH3 hoặc CH5N. Chúng là các chất có khả năng làm tăng pH.
Với lượng đủ lớn, chúng không chỉ trung hòa được axit trong mưa, mà còn tạo ra các bazơ tan trong nước mưa. Kết quả chính là mưa bazơ - hiện tượng trái ngược với mưa axit.
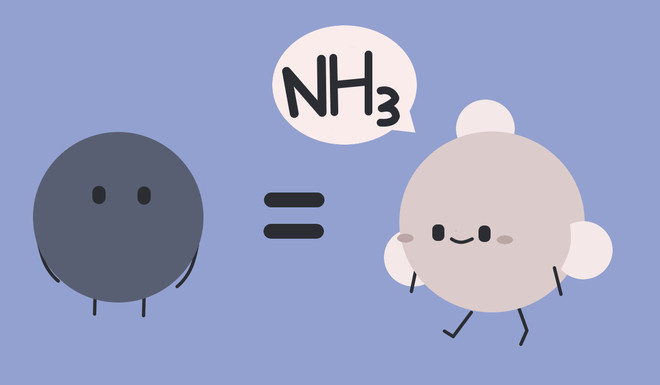
Bầu không khí chứa CaCO3, NH3 hoặc CH5N sẽ xuất hiện mưa bazơ thay vì mưa axit.
Trong tự nhiên, khả năng xuất hiện của hai nhóm đều nhỏ tương đương nhau. Tuy nhiên, nhóm khí gây ra tính axit xuất hiện nhiều hơn từ các hoạt động gây ô nhiễm của con người. Chính vì vậy, mưa axit xảy ra thường xuyên và không quá khó để bắt gặp.
Ngược lại, các hoạt động tạo ra nhóm khí bazơ lại chỉ có thể đếm trên đầu ngón tay, nên chúng hiếm hơn nhiều cũng là điều dễ hiểu.
Ngoài ra, do nước mưa vốn hơi có tính axit do CO2, nên lượng khí phụ đòi hỏi để tạo ra mưa axit sẽ thấp hơn mưa bazơ. Cùng một lượng nước mưa, chỉ cần 1 phần (H+) để tạo mưa axit nhưng cần tới 2,5 phần (OH-) để tạo mưa bazơ. Điều này giống như trò chơi kéo co mà tự nhiên vốn lại thiên vị phe axit vậy.
Hiện tượng này tuy hiếm gặp nhưng đã gợi ý một giải pháp để chống lại tác hại của mưa axit với nguyên lí để bazơ trung hòa axit, tạo ra nước và các hợp chất ít có hại hơn cho môi trường sống của con người.
Các nhà khoa học từng thử vận dụng tại một số nơi thường xuyên bị ảnh hưởng xấu của mưa axit và đã nhận được kết quả khá mĩ mãn.

Những cơn bão lớn nhất được ghi nhận trong lịch sử
Trong quá khứ có không ít cơn bão với sức gió mạnh kỷ lục nhưng lại không gây ra nhiều thiệt hại.

Động đất là gì? Động đất được hình thành như thế nào?
Động đất là hiện tượng rung động đột ngột của vỏ Trái đất, mạnh hay yếu tuỳ từng trận (xác định bằng độ Richter).

Sấm sét là gì? Tại sao có sấm sét?
Một hiện tượng thiên nhiên đặc biệt phổ biến xảy ra ở khắp mọi nơi trên trái đất của chúng ta, đó là sấm sét. Nó là một luồng điện cực mạnh và sẵn sàng phá hủy mọi thứ mà nó phóng xuống.

Núi lửa là gì? Núi lửa được hình thành như thế nào?
Núi lửa đã gây ra rất nhiều ảnh hưởng đến đời sống của những người đang sống trong vùng gần cửa miệng của hiện tượng này. Nhưng đã bao giờ bạn tử hỏi núi lửa là gì không?

Đảo rắn Brazil - nơi kinh hoàng nhất thế giới
Đảo rắn tại Brazil sở hữu vẻ đẹp tựa thiên đường nhưng với gần 400.000 con rắn độc bậc nhất thế giới vừa là nỗi sợ, vừa kích thích sự hiếu kỳ của du khách ưa mạo hiểm.
Hiệu ứng nhà kính là gì?
Hiệu ứng nhà kính là hiệu ứng làm cho không khí của Trái đất nóng lên do bức xạ sóng ngắn của Mặt trời có thể xuyên qua tầng khí quyển chiếu xuống mặt đất; mặt đất hấp thu nóng lên lại bức xạ sóng dài vào.





