Những ứng viên tiềm năng của cuộc đua vaccine phòng Covid-19
Ngoài vaccine vừa phê duyệt của Nga, thế giới có hơn 150 loại đang được gấp rút phát triển, một số có thể sử dụng từ tháng 10.
Hôm qua (11/8), Nga tuyên bố phê duyệt vaccine phòng Covid-19. Bộ trưởng Y tế Nga Mikhail Murashko cho biết quốc gia này lên kế hoạch sẽ tiêm chủng hàng loạt miễn phí vaccine Covid-19 vào tháng 10. Đây là quốc gia dẫn đầu cuộc đua vaccine.
Theo National Geographic, khoảng 150 loại vaccine đang cùng lúc được phát triển. Nhiều nơi tích cực đẩy mạnh tiến trình nghiên cứu, hứa hẹn sớm đưa vào sản xuất chế phẩm này.
Những ứng cử viên sáng giá
Trên thế giới, nhiều ứng cử viên khác cũng nỗ lực để hoàn thiện vaccine đang nghiên cứu.
- mRNA-1273 (Công ty Moderna phối hợp cùng Viện Y tế Quốc gia Mỹ): Được thiết kế để tạo ra các kháng thể trung hòa, nhắm vào một phần protein corikeavirus và spike - vật chất mà virus sử dụng để liên kết và xâm nhập vào tế bào người.
Họ tạo ra các protein virus bắt chước SARS-CoV-2, huấn luyện hệ miễn dịch sinh cơ chế nhận diện virus. Công nghệ này chưa từng được sử dụng trước đây. Do đó, nếu được cấp phép, mRNA-1273 sẽ là chế phẩm sinh học đầu tiên ứng dụng phương pháp nói trên ở người.
Ngày 27/7, Moderna tuyên bố họ đã bắt đầu giai đoạn ba của thử nghiệm lâm sàng cho vaccine mRNA-1273. Dự kiến, 30.000 ứng cử viên Mỹ sẽ tham gia thử nghiệm. Moderna cũng cho biết họ đang bám sát kế hoạch đề ra và đi đúng hướng, hứa hẹn sẽ có ít nhất 500 triệu liều vaccine mỗi năm, bắt đầu từ năm 2021.
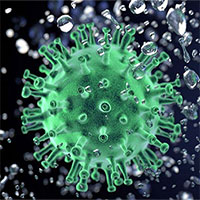
Hơn 150 loại vaccine Covid-19 đang được phát triển cùng lúc trên toàn thế giới. (Ảnh: Reuters).
- BNT162b2 (Công ty dược phẩm Pfizer và công ty công nghệ sinh học BioNTech, Đức): Tương tự mRNA-1273, BNT162b2 cũng dựa trên liệu pháp mRNA, phát triển từ công nghệ điều chế vaccine chữa ung thư trước đó của BioNTech.
Kết quả sơ bộ của giai đoạn một cho thấy BNT162b2 tạo ra kháng thể và phản ứng tế bào T đặc hiệu với protein SARS-CoV-2. Dự án tiếp tục kết hợp giai đoạn 2, 3 của quá trình điều chế vaccine và bắt đầu thử nghiệm từ ngày 27/7.
30.000 người dân tại 39 tiểu bang của Mỹ, Brazil, Argentina, Đức tham gia giai đoạn nói trên. Pfizer cho biết họ đã ký hợp đồng gần 2 tỷ USD với chính phủ Mỹ để cung cấp 100 triệu liều vào tháng 12. Nhóm hướng tới việc sản xuất 1,3 tỷ liều vào cuối năm 2021.
- ChAdOx1 nCoV-19 (Đại học Oxford, Anh, hợp tác với công ty dược phẩm sinh học AstraZeneca): Khác 2 ứng cử viên trên, ChAdOx1 nCoV-19 sử dụng cơ chế vector virus, hình thành “con ngựa Trojan” cho hệ miễn dịch. Nhóm nghiên cứu chuyển protein tăng đột biến SARS-CoV-2 giúp virus xâm nhập tế bào vào phiên bản yếu của adenovirus - loại gây cảm lạnh thông thường. Khi adenovirus được tiêm vào người, protein tăng đột biến sẽ kích hoạt phản ứng miễn dịch.
Thử nghiệm lâm sàng đầu tiên của dự án vaccine này đã cho thấy hiệu quả. Nhóm đang tìm kiếm 50.000 tình nguyện viên ở Brazil, Anh, Mỹ và Nam Phi cho giai đoạn thử nghiệm trên người. AstraZeneca và Oxford có kế hoạch sản xuất một tỷ liều vaccine và sẽ bán với giá gốc.
- CoronaVac (Sinovac của Trung Quốc hợp tác trung tâm nghiên cứu Brazil Butantan): Đây là loại vaccine bất hoạt, sử dụng phiên bản không lây nhiễm của SARS-CoV-2. Mặc dù không có khả năng gây bệnh, chúng vẫn có thể kích hoạt các phản ứng miễn dịch.
Hiện loại vaccine này được cấp phép thử nghiệm giai đoạn 3. Thử nghiệm trước đó cho thấy hiệu quả tạo ra phản ứng miễn dịch, không kèm tác dụng phụ nào nghiêm trọng. Công bố trên tạp chí Science của nhóm dự án tiết lộ vaccine CoronaVac có thể tạo ra kháng thể trung hòa 10 chủng SARS-CoV-2.
- Sinopharm (Công ty dược phẩm Sinopharm hợp tác cùng Viện Sinh học Vũ Hán): Vaccine bất hoạt của nhóm nghiên cứu đến từ Trung Quốc hứa hẹn sẽ tung ra thị trường vào cuối năm nay. Giai đoạn 3 của thử nghiệm vaccine đã được tiến hành vào giữa tháng 7 với 15.000 tình nguyện viên, độ tuổi 18-60. Công ty chọn người dân tại UAE để thử nghiệm bởi chủng tộc đa dạng, khoảng 200 quốc tịch khác nhau sinh sống tại đây.
- Ad5-nCoV (Công ty dược phẩm CanSino Biologics, Trung Quốc): Cũng là loại vaccine vector, Ad5-nCoV cho kết quả sơ bộ có tạo ra các phản ứng miễn dịch đáng kể từ thử nghiệm giai đoạn 2. Theo công bố trên tạp chí The Lancet, không có tác dụng phụ nào được ghi nhận trong quá trình trên. Chính phủ Trung Quốc đã phê duyệt loại vaccine này chỉ sử dụng cho quân đội trong thời gian một năm.
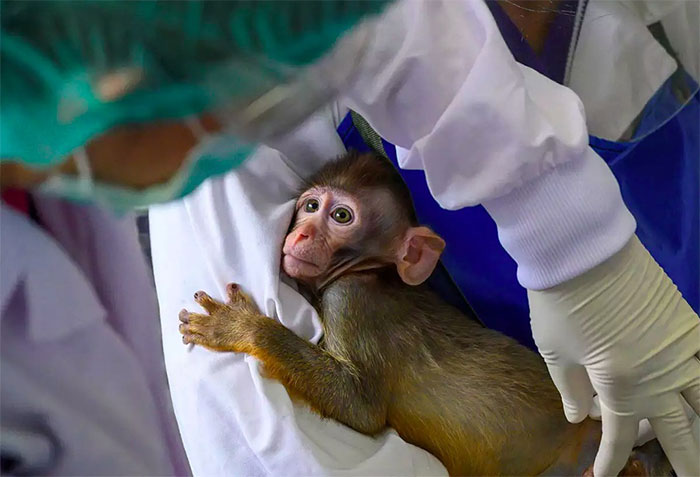
Trước khi đưa ra thị trường, vaccine phải trải qua nhiều giai đoạn thử nghiệm phức tạp ở động vật và người. (Ảnh: Reuters).
Quá trình phát triển phức tạp và đòi hỏi thời gian
Vaccine trước khi đưa ra thị trường phải mất 10-15 năm với các nghiên cứu, thử nghiệm ở động vật và người để chứng minh độ an toàn và hiệu quả. Trước đây, vaccine phòng quai bị là loại chế phẩm được phát triển nhanh nhất với thời gian 4 năm và bắt đầu được sử dụng từ năm 1960.
Mỗi loại vaccine phải trải qua quá trình thử nghiệm lâm sàng với nhiều giai đoạn, bắt đầu là kiểm tra sự an toàn và liệu chúng có thể kích hoạt phản ứng miễn dịch ở một nhóm người khỏe mạnh hay không. Giai đoạn 2 sẽ mở rộng với cả những người bị bệnh hoặc khả năng mắc bệnh cao hơn để đánh giá tiếp hiệu quả.
Giai đoạn 3 tiến tới thử nghiệm trên hàng nghìn người để đảm bảo tính an toàn và tác dụng của nó trong cộng đồng. Bởi phản ứng miễn dịch có thể thay đổi theo độ tuổi, chủng tộc hoặc tình trạng sức khỏe tiềm ẩn. Sau đó, các cơ quan quản lý sẽ đánh giá và phê duyệt vaccine. Giai đoạn này có thể kéo dài tới vài năm. Và ngay cả khi được phê duyệt, vaccine vẫn phải đối mặt với những rào cản tiềm tàng khi sản xuất, phân phối, định giá sản phẩm.
Với vaccine phòng, chống virus SARS-CoV-2, các dự án phát triển tìm cách đẩy nhanh giai đoạn thử nghiệm lâm sàng và quá trình phê duyệt. Tuy nhiên, để tung ra thị trường, nó vẫn cần những đánh giá chuyên môn.
Bão cytokine - hiện tượng khiến cơ thể tự hủy hoại trước virus corona
Hiện tượng đặc biệt này sẽ khiến cơ thể con người tự gục ngã vì chính hệ miễn dịch của mình.
Hàn Quốc phát hiện ba chủng Covid-19 đột biến mới, các bác sĩ chưa rõ độc lực
3 biến chủng virus nCoV mới vừa được phát hiện tại Hàn Quốc có nguồn gốc từ Pakistan và Uzbekistan, hiện chưa rõ độc lực của chúng ra sao so với các chủng đã ghi nhận.

Tổng thống Putin tuyên bố Nga đã có vaccine Covid-19
Tổng thống Nga tuyên bố nước này đã phát triển loại vaccine đầu tiên cung cấp khả năng "miễn dịch bền vững" chống Covid-19.

14 loại khẩu trang phòng Covid-19: Loại nào phản tác dụng nhất?
Theo một nghiên cứu mới tại Mỹ, khẩu trang dệt kim và khăn trùm từ cổ lên mặt là những loại che chắn kém hiệu quả nhất trong việc phòng dịch Covid-19.

Các nhà khoa học Nhật Bản dùng tằm để phát triển vaccine Covid-19
Các nhà khoa học Nhật Bản đang sử dụng tằm để sản xuất protein phục vụ phát triển vaccine ngăn ngừa sự lây lan của virus corona.
Vắc-xin đầu tiên trên thế giới chống Covid-19 sẽ được đăng ký vào tuần tới
Thứ trưởng Bộ Y tế Nga Oleg Gridnev cho hay, vào ngày 12/8 tới, vắc-xin chống Covid-19, do Trung tâm Gamaleya phát triển sẽ được đăng ký ở Nga.